FILARIASIS
Antecedentes
históricos
Al revisar la historia documentada acerca de las dermatofitosis se hace
evidente que éstas son conocidas desde la Antigüedad y que fueron los romanos
quienes crearon el término tinea, que significa “apolillado”. Dicho
concepto fue utilizado desde el siglo v por Cassius, refiriéndose al
aspecto clínico de la tiña de la cabeza; sin embargo, se creía que estos
padecimientos eran causados por insectos o gusanos; tanto es así que, de hecho,
el término en inglés ringworm (anillo-gusano) es un ejemplo de
la fusión del aspecto clínico y la etiología confusa. También se tienen
vestigios del conocimiento de las tiñas de la cabeza por la pintura de Murillo
“Santa Isabel de Hungría curando tiñosos” (ubicada en la iglesia de San Jorge,
Sevilla), aunque la obra inspirada en apuntes del siglo xiii fue
pintada cuatro siglos más tarde.
En la América precolombina, gracias al tratado de fray Bernardino de
Sahagún, hay descripciones que podrían corresponder a estos padecimientos.
Todos estos hechos son indicios del conocimiento de las tiñas; no obstante, los
estudios científicos y comprobados comenzaron hasta el siglo xix con
los trabajos de Remark, quien en 1834 analizó el favus y
observó bajo el microscopio múltiples filamentos, por lo que consideró como un
tipo de vegetales como causantes de la enfermedad.
Una particularidad de sus investigaciones
es que se basan en la autoexperimentación, pues Remark se inoculó directamente
las costras de los pacientes, sin éxito, debido a que la enfermedad no se
reprodujo en él. Dado a que Remark era judío y el antisemitismo una práctica
común a principios del siglo xix, estos primeros trabajos no fueron
divulgados sino hasta 1839 por Schoenlein. De aquí surgieron los primeros
nombres del agente etiológico del favus como Oidium
schoenleinii y Achorion schoenleinii. Tiempo después Gruby
realizó una serie de estudios, dentro de los que sobresalen el aislamiento
de C. albicans a partir del muguet; el descubrimiento de
diversos dermatofitos, la creación del género Microsporum, así como
el aislamiento de M. canis y M. audouinii. En
1841, Schoenlein continuó los estudios de Remark: aisló el agente etiológico.
Epidemiología
Las
filariasis clásicas están producidas por varios nematodos de la familia
Filaroidea, siendo las principales que afectan a humanos Wuchereria bancrofti, Brugia malayi, Brugia timori, Onchocerca
volvulus, Loa loa, Mansonella perstans, Mansonella streptocerca y Mansonella
ozzardi. Actualmente hay otras filariasis zoonóticas que muy
infrecuentemente afectan al hombre, como por ejemplo O. jakutensis, O. dewittei, B. pahangi, Pelecitus spp. o como Meningonema peruzzii, descritas en
remotos lugares del mundo3-7, o más próximos como O. lupi en Italia8, y
Dirofilaria immitis y D. repens en España9. Los vectores responsables de
transmitir las infecciones varían en función de las localizaciones geográficas
y, por ello, la distribución de las filariasis en el mundo es muy variable.
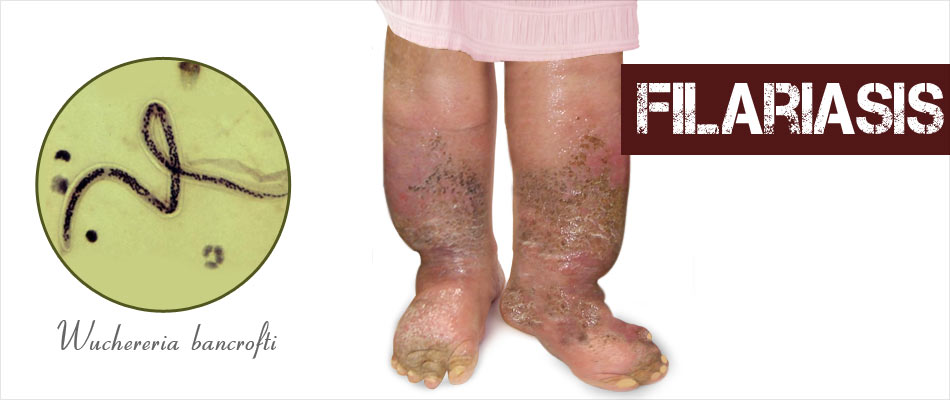
Wuchereria
bancrofti y Brugia malayi/timori
La
filariasis linfática producida por W. bancrofti está presente en 83 países de
África Subsahariana, Sudeste Asiático, subcontinente indio, algunas islas del
Pacífico y en áreas focales de Latinoamérica. Brugia malayi se localiza en zonas del este y sur de Asia, India,
Indonesia, Malasia, Filipinas y algunas islas del Pacífico. Brugia timori se circunscribe a las
Islas de Timor e Indonesia. Los mosquitos implicados en la transmisión
pertenecen al género Anopheles, Culex,
Aedes y Mansonia. Se estima que
unos 120 millones de personas de áreas tropicales y subtropicales están
infectadas por filarias linfáticas, de las que al menos 25 millones de hombres
tienen enfermedad genital y 15 millones tienen linfedema10. Clásicamente, la
adquisición de una filariasis por el viajero se ha asociado a estancias
prolongadas, pero hay casos descritos de viajeros infectados tras una
permanencia corta en zona no endémica, incluso inferior a 10 días11-13.
Onchocerca
volvulus
La
filariasis producida por O. volvulus está presente en 34 países,
fundamentalmente en África Subsahariana y Yemen, aunque hay algunos pequeños
focos en América Central y del Sur. Se transmite mediante la picadura de la
mosca negra del género Simulium, que tiene su ecosistema en aguas muy
oxigenadas de los ríos; por ello, a esta enfermedad se la conoce también como
ceguera de los ríos14. En zonas hiperendémicas (p. ej., en las riveras de los
ríos de zonas endémicas) más del 60% de la población presenta microfilarias en
la piel. Se estima una prevalencia de oncocercosis de 37 millones, de los que
cerca de 500.000 personas presentan afectación visual y la mitad padecen
ceguera irreversible10. Simulium es un vector poco eficiente y para el
desarrollo de la enfermedad son necesarias multitud de picaduras infectivas,
habiéndose estimado en unos 12 meses la estancia mínima en un área endémica
para adquirir la enfermedad. Por ello, es menos probable el diagnóstico en
viajeros de corta estancia, aunque se han descrito algunos casos.
Loa
loa
La
filariasis producida por Loa loa se circunscribe a regiones centrales y del
oeste de África. Se transmite mediante la picadura de la mosca (tábano) Chrysops
que vive en áreas pantanosas16. Se estima que entre 3 y 13 millones de personas
están afectadas.
Mansonella
spp. M. perstans y M. streptocerca
Afectan
principalmente a zonas centrales de África, y M. ozzardi se ciñe a América
Central (área peninsular y Caribe) y América del Sur. Estas 3 especies se
transmiten mediante la picadura de moscas del género Culicoides. No hay buenas
estimaciones de la carga de estas enfermedades en el ámbito mundial.
Ciclo biológico y patogenia
Los
ciclos biológicos tienen gran similitud entre las distintas filarias (fig. 1).
La fase parasitaria responsable de las manifestaciones clínicas es el helminto
adulto en el caso de W. bancrofti y B. malayi/ timori, la microfilaria en el
caso de O. volvulus o ambas fases en el caso de L. loa y Mansonella spp.
Wuchereria
bancrofti y Brugia malayi/timori
Tras
la picadura del insecto vector, las larvas infectivas se depositan en la piel
para migrar a través de la dermis hacia los vasos linfáticos locales. En los
siguientes 6-12 meses, la larva madura hasta convertirse en adulto y alcanza
los ganglios linfáticos, donde vive durante períodos que oscilan entre los 5 y
los 12 años. Tras la cópula de los adultos, se producen microfilarias que,
dependiendo de la especie, se liberan a la sangre. La vida media de las
microfilarias es de entre 3 meses y 3 años, dependiendo del agente etiológico.
La captación desde la sangre de las microfilarias por el insecto adecuado
cierra el ciclo biológico.
Onchocerca
volvulus
Tras
la picadura de un Simulium infectado, las larvas infecciosas son depositadas en
la piel del hombre, donde se transformarán en adultos pasados unos 6-12 meses.
Los adultos vivirán ovillados hasta 15 años en nódulos subcutáneos liberando
microfilarias microscópicas que migran a través del tejido subcutáneo,
conjuntival e intraocular. Las microfilarias subcutáneas, que viven entre 6-24
meses, serán ingeridas por las moscas, completando así el ciclo. La patogenia
se caracteriza por la sustitución del colágeno y fibras elásticas por fibroblastos,
con lo que la piel adquiere una característica apariencia envejecida. Las
macrofilarias viven encapsuladas en los nódulos (oncocercomas) sin producir
sintomatología. Las microfilarias vivas jóvenes migran a través de la piel y
del ojo sin que aparentemente se vean afectadas por la respuesta inmune o
inflamatoria del hospedador, pero las microfialrias moribundas producen una
marcada respuesta inflamatoria (no está claro qué es lo primero, si la muerte o
la inflamación) cutánea y ocular.
La
severidad de la oncodermatitis está directamente relacionada con la actividad
citoadherente y la proliferación celular del huésped, e inversamente
correlacionada con la carga de microfilarias32 mediante un fenómeno de
inmunointolerancia a los antígenos de Onchocerca y no a los de Wolbachia33. Sin
embargo, tanto los antígenos de Onchocerca como los de Wolbachia liberados
durante la muerte de las microfilarias son los responsables de la inflamación
corneal y de la eventual ceguera30,34. La ceguera, característicamente, es
mucho más frecuente en las áreas de sabana que en las de zona tropical.
Loa
loa
Las
larvas infecciosas se transmiten al hospedador tras la picadura infectiva del
tábano Chrysops, cuyos hábitos alimenticios son exclusivamente diurnos16. Tras
6-12 meses las larvas van madurando hasta convertirse en adultos muy móviles
que migran a través del tejido subcutáneo y de la conjuntiva. Los gusanos
adultos pueden vivir hasta 17 años, liberando microfilarias al torrente
sanguíneo, desde el que pueden ser ingeridas por el vector al alimentarse con
la sangre y así completar el ciclo. Se postula que la mayoría de las
manifestaciones clínicas están mediadas inmunológicamente. Así, los angioedemas
subcutáneos se deben a la reacción de hipersensibilidad del adulto migrando a
través del tejido subcutáneo y a la eliminación de las microfilarias. La
afectación sistémica más grave deriva de la respuesta inmune del hospedador
frente a los antígenos del parásito, en forma de miocardiopatía en pacientes
con eosinofilia intensa, nefropatía por depósito de inmunocomplejos o
encefalitis por presencia de microfilarias en el líquido cefalorraquídeo.
Mansonella spp. Las larvas infectivas de Mansonella se transmiten al hospedador
a través de la picadura de Culicoides. Tras un período de meses a años estas
larvas se transformarán en helmintos adultos y liberarán microfilarias que
residen en la capa dérmica superior y en capas colágenas de la piel. Mansonella
está bien adaptada al hospedador y provoca una mínima reacción inflamatoria en ausencia
de tratamiento. Sin embargo, con la terapia filaricida aparecen reacciones
inflamatorias alrededor del gusano adulto y microfilarias, lo que sugiere que
el parásito está liberando antígenos a los que responde el sistema inflamatorio
del hospedador.
Manifestaciones clínicas:
Las
filariasis pueden producir una amplia variedad de manifestaciones clínicas, que
van desde casos aparentemente asintomáticos hasta manifestaciones más graves.
En general, la importancia clínica de esta enfermedad viene dada por la elevada
morbilidad a la que se asocia, sobre todo en zonas endémicas, donde producen
gran discapacidad y deformidad, lo que conlleva un impacto socioeconómico muy
importante.
Wuchereria
bancrofti y Brugia malayi/timori
Pueden
cursar con microfilaremia asintomática, con manifestaciones agudas como la
fiebre filarial (episodios autolimitados de fiebre sin otros síntomas
acompañantes) o la adenolinfangitis. Las manifestaciones crónicas son
secundarias a la obstrucción de la circulación linfática. La más característica
es el linfedema, habitualmente en miembros inferiores y escroto, que tiene gran
tendencia a la sobreinfección bacteriana y puede evolucionar a elefantiasis.
También puede producir patología testicular (hidrocele, epididimitis) o renal
(quiluria y hematuria). Aunque todas las especies que producen filariasis
linfática cursan de manera similar, las manifestaciones producidas por las
especies de Brugia spp. suelen ser más leves, sin afectación escrotal y están
limitadas a miembros inferiores. La eosinofilia pulmonar tropical aparece en el
0,5% de las filariasis linfáticas y es más típica de varones jóvenes. Está
causada por una reacción inmunológica desencadenada por las microfilarias
presentes en los pulmones y cursa con tos no productiva, eosinofilia, febrícula
y patrón intersticial en la radiografía de tórax. Característicamente no se
encuentran microfilarias en sangre y los anticuerpos antifilaria están
presentes a títulos altos. En viajeros raramente se presentan como
microfilaremia asintomática y son más susceptibles de cursar con
hepatoesplenomegalia, linfadenitis y edema, que característicamente suele ser
reversible
Onchocerca
volvulus
Produce
clínica fundamentalmente cutánea, subcutánea y en estructuras oculares. Las
microfilarias sobreviven en la piel de 12-18 meses, tras lo cual mueren
produciendo una reacción local consistente en prurito, dermatitis papular y
sowda. Los pacientes crónicamente infectados pueden presentar afectación
cutánea en forma de despigmentación de la piel (piel de leopardo), o pérdida de
estructuras elásticas cutáneas y envejecimiento prematuro de ésta
(presbidermia). También son típicos los nódulos subcutáneos (oncocercomas)
donde viven los helmintos adultos, localizados típicamente sobre prominencias
óseas y distribuidos característicamente en hemicuerpo superior en América y en
hemicuerpo inferior en África. Las manifestaciones visuales en la oncocercosis
incluyen la queratitis puntiforme o esclerosante, la iridociclitis, y las
lesiones retinianas y del nervio óptico, que pueden producir pérdida de visión.
Estas manifestaciones son el resultado de la migración de microfilarias a los
tejidos oculares y de la posterior respuesta provocada por la muerte de éstas.
Es obligada, por tanto, una valoración oftalmológica completa que incluya el
examen con lámpara de hendidura para investigar la presencia de alteraciones
oculares características. En viajeros suele cursar fundamentalmente con prurito
y dermatitis, pero es extremadamente infrecuente que presenten nódulos o afectación
ocular
Loa
loa
Suele
cursar de forma asintomática, presentando exclusivamente eosinofilia y
microfilaremia. Cuando produce sintomatología, ésta se caracteriza por la
presencia de angioedema en miembros superiores o cara y de carácter transitorio
(edema de Calabar). La afectación ocular se produce por la migración del adulto
a través de la conjuntiva ocular, causando inflamación y edema conjuntival
transitorio. En viajeros suele ser más frecuentemente sintomática y cursa,
sobre todo, con síntomas relacionados con la respuesta inmune, fundamentalmente
edema de Calabar, prurito, urticaria y asma37, así como migración de la larva
por el globo ocular38. En este tipo de pacientes difícilmente se detectan
microfilarias en sangre, ya que la carga de microfilarias es baja
Mansonella
spp. M. perstans y M. ozzardi
Cursan
de forma asintomática o con síntomas inespecíficos secundarios a la respuesta
inmune (prurito, artralgias, fiebre) y raramente con síntomas más específicos
(edemas tipo Calabar o pericarditis en M. perstans). M. streptocerca puede
producir alteraciones cutáneas similares a las de la oncocercosis que
dificultan el diagnóstico. Aunque hay pocos casos descritos en la literatura en
viajeros, en general cursan más frecuentemente con edemas y afectación
sistémica que en sujetos inmunes3<
Tratamiento
Para
la correcta elección del tratamiento es importante valorar: a) la presencia de
coinfecciones por distintas filarias; b) la carga parasitaria (cantidad de
microfilarias por mililitro de sangre o por pellizco cutáneo); c) la afectación
linfática u ocular avanzada; d) si la filaria posee la bacteria endosimbiótica
Wolbachia, y e) si se trata de un enfermo residente de manera permanente en
área endémica o se trata de un inmigrante o un viajero (que, en general, no
sufrirá reinfecciones).
Wuchereria
bancrofti y Brugia malayi/timori
El
tratamiento de elección de un caso importado es la DEC: 6 mg/ kg/día, repartido
en 3 tomas al día durante 12 días. Para pacientes con elevada carga parasitaria
se recomienda iniciar el tratamiento con una dosis baja e irla aumentando
progresivamente: 1.er día 50 mg, 2.º día 50 mg 3 veces al día, 3.er día 100 mg
3 veces al día y del 4-14.º día 6 mg/kg/día, repartido en 3 tomas al día60.
Onchocerca
volvulus
El tratamiento de elección es la ivermectina:
dosis única de 150 g/kg repetida cada 6-12 meses hasta la curación (hasta
quedar asintomático, generalmente durante varios años, hasta 10). Incluso la
ivermectina, que es un microfilaricida muy lento (lo que evita la muerte masiva
de las microfilarias y la consiguiente suelta antigénica), puede producir
reacciones cutáneas en sujetos con alta carga parasitaria.
Loa
loa
El
tratamiento de elección de un caso con muy baja carga parasitaria es la DEC: 6
mg/kg/día, repartido en 3 tomas al día durante 12 días. Al igual que en el caso
de las filariasis linfáticas, en sujetos con moderada carga parasitaria se
recomienda la pauta escalonada de DEC: 1.er día 50 mg, 2.º día 50 mg 3 veces al
día, 3.er día 100 mg 3 veces al día y del 4-14.º día 9 mg/kg/día repartido en 3
tomas al día. Los corticoides (prednisolona 20 mg/día desde 3 días antes de
iniciar el tratamiento hasta 3 días después de iniciarlo) se suelen asociar
para evitar la aparición de efectos secundarios60. C
Mansonella
spp. – Mansonella perstans.
No
hay un tratamiento óptimo aprobado, aunque en general se recomienda albendazol
(400 mg /12 h durante 10 días) o mebendazol (100 mg/12 h durante 30 días). La
ivermectina ha demostrado poca eficacia, aunque dosis repetidas pueden reducir
la microfilaremia. La DEC es de eficacia variable y rara vez conduce a la
eliminación de las microfilarias mantenida en el tiempo. En los últimos años se
ha probado con éxito la doxiciclina (200 mg/ día durante 6 semanas), por lo que
es posible que en un futuro sea el tratamiento de elección.
Prevención y control
En
el año 2000, la OMS estableció el “Programa para la eliminación de las
filariasis linfáticas”, cuyo objetivo era erradicar la enfermedad para el año
2020 (fig. 2)58. De los 72 países en los que la filariasis linfática está
considerada endémica, 53 han implementado la administración en masa de fármacos
para parar la transmisión10. La administración en masa de fármacos en áreas
endémicas demostró ser más coste-efectiva que la detección y tratamiento de los
individuos infectados.
El
programa de la OMS tiene 2 objetivos fundamentales: a) la interrupción de la
transmisión mediante la administración de medicamentos eficaces a toda la
población en riesgo de padecer la enfermedad, conocida como administración de
fármaco en masa, y por otro lado, b) la mejora de las condiciones y prevención
de las complicaciones en los sujetos que ya padecen la enfermedad (fomentando
la higiene de la piel en caso de linfedema, o facilitando la cirugía a los
hombres con hidrocele).
La
interrupción de la transmisión de la filariasis linfática sólo puede
conseguirse si toda la población en riesgo es tratada en masa por un período lo
suficientemente largo como para asegurar la reducción en el nivel de la
microfilaremia hasta un punto tal en el que la transmisión ya no sea factible.
Para ello, debe administrarse 1 vez al año durante al menos 5 años, con una
cobertura de al menos el 50% de la población en riesgo.
Se utiliza una dosis de la combinación de DEC
6 mg/kg + albendazol 400 mg o en áreas de coendemicidad con O. volvulus se
utiliza la combinación de 1 dosis de ivermectina 150 g/g + albendazol 400 mg
(tabla 4). Se han utilizado con mucho éxito las campañas que proporcionan a la
población sal enriquecida con DEC (1-3 g de DEC por kg de sal). La terapia con
doxiciclina frente a Wolbachia para el control de la filariasis en el ámbito
comunitario se ve comprometida por la duración prolongada del tratamiento y por
sus efectos secundarios en niños y embarazadas.





No hay comentarios:
Publicar un comentario